电话:027-87686090
地址:湖北省武汉市洪山区珞喻路237号 (430079)
邮箱:esev2022@126.com
近年来,对实体组织中EV的研究十分火热,本部分将以口腔鳞状细胞癌为例对组织中EV的分离进行介绍。实体组织中提取EV的方法主要有2种:酶消化法和组织培养法。
(一)胶原酶消化法
1. 原理:胶原酶消化细胞外基质,释放细胞间隙中的EV。
2. 试剂准备
(1)胶原酶IV:分装适当浓度胶原酶IV溶液(推荐分装浓度10 mg/ml),避免反复冻融。胶原酶IV溶液在-20 ℃下可稳定数月,4 ℃条件下稳定1周。推荐浓度1 mg/ml~2 mg/ml用于人头颈部鳞状细胞癌组织解离。如需无菌处理,分装前应将胶原酶IV使用0.22 μm滤器过滤。
(2)DNase I:分装适当浓度DNase I溶液,避免反复冻融,该溶液在-20 ℃可稳定9个月。建议工作浓度为0.1 mg/ml-0.2 mg/ml,防止消化液黏稠,预防EV聚集。
(3)制备含有用RPMI 1640稀释的胶原酶IV和DNA酶I的组织解离溶液,放在冰上或4 ℃备用。
3. 分离步骤
(1)将组织样品放入含HBSS、RPMI 1640或生理盐水的离心管中,冰上转移至实验室;
(2)用预冷的PBS洗涤以除去血液;
(3)在装有RPMI 1640的6 cm培养皿中,从样品中剔除坏死组织和脂肪组织,并切取肿瘤组织约黄豆大小(100 mg左右);
(4)用预冷的PBS洗涤肿瘤组织,并用无菌纱布吸干肿瘤组织表面水分并使用精密天平记录重量;
(5)在1.5 ml EP管中加入2滴RPMI-1640,用显微剪刀在EP管中将肿瘤组织剪成小于1 mm的小块,如图1所示;(注:组织剪得越碎越好;不推荐研磨或匀浆机等存在挤压力的处理方式,因为研磨和匀浆会造成大量细胞损伤和破裂)
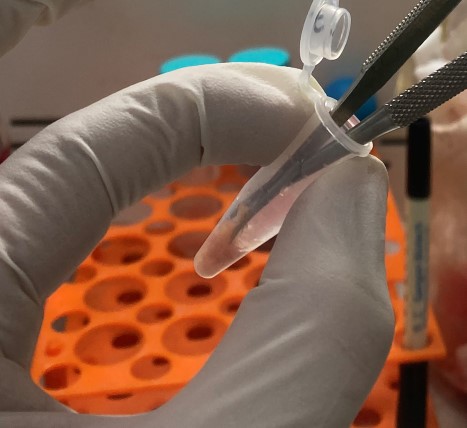
图1 剪碎组织
(6)将EP管内碎组织和溶液转移至6孔板或12孔板中,并加入消化液1.5 ml-2 ml(含胶原酶IV和DNase I),在37 ℃振荡培养箱中孵育1 h,500 rpm,消化前后对比如图2所示;(注:振荡培养箱转动速度可适当提高,确保液体不被摇出即可;也可将孔板放于普通培养箱中,每隔15 min轻轻摇晃数次)
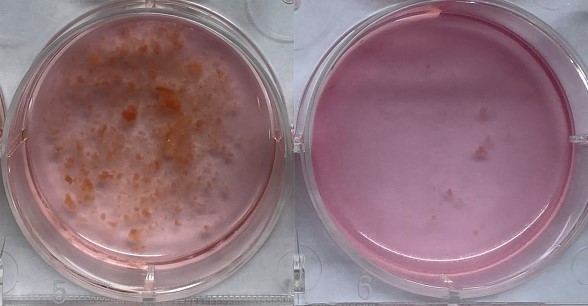
图2 胶原酶IV消化前后对比(左:消化前,右:消化后)
(7)70 μm尼龙网或滤器过滤消化液;
(8)将过滤后的消化液以300 × g,10 min,4 ℃离心,获得细胞;(注:对细胞进行台盼蓝染色可检验胶原酶消化对细胞活性的影响)
(9)取上清,2,000 × g,20 min,4 ℃,弃沉淀(胶原酶IV颗粒、细胞碎片等);
(10)10,000 × g,45 min,4 ℃,弃沉淀(进一步去除胶原酶IV颗粒和大EV);
(11)120,000 × g,70 min,4 ℃,100 μl PBS重悬沉淀(沉淀如图3示),根据BCA或NTA的结果分装后于-80 ℃保存。

图3 EV沉淀
4. 优缺点
(1)优点:相较于组织培养法,胶原酶消化法耗时较短,且分离得到的EV更能代表组织间隙中的EV。
(2)缺点:胶原酶的使用,会引入非囊泡的酶颗粒,降低获得EV的纯度。
(二)组织培养法
1. 原理:剪碎的组织会缓慢向细胞培养基中释放EV,细胞在培养过程中也会分泌EV。
2. 分离步骤
(1)-(4)组织样品处理同胶原酶消化法;
(5)在6孔板中,用剪刀将肿瘤组织剪成1 mm~2 mm小块(<10块/孔),注意剪碎过程中保持组织湿润;
(6)如果条件允许,可让组织块贴在皿数分钟,然后沿皿壁缓慢加入RPIM-1640,避免吹起组织块,并没过组织块;
(7)转移至37 ℃,5% CO2培养箱中,培养16-18 h;
(8)收集培养液,如组织块需要继续培养,应注意小心收集培养液,减少组织块脱落;(注:如需长期培养组织块,应考虑将Exosome-free 血清和其他必需生长因子添加到培养基中)
(9)离心培养液300 × g 10 min,4 ℃,将上清液转移到新管中;
(10)取上清,2,000 × g,20 min,4 ℃,弃沉淀,取上清;
(11)10,000 × g,45 min,4 ℃,弃沉淀(进一步去除大EV);
(12)120,000 × g,70 min,4 ℃,100 μl PBS重悬沉淀,根据BCA或NTA的结果分装后于-80 ℃保存。
注意:根据许多因素,组织体外培养活力会有所不同,例如手术方法,培养时间和组织成分。鉴于组织样本的复杂性以及与细胞系相比存在大量碎片,务必执行上述三个超速离心前步骤(300 × g、2,000 × g和10,000 × g)以去除不溶性物质,并可根据实际情况添加过滤或其他纯化步骤。
3. 优缺点
(1)优点:经济实惠,避免了酶消化过程对细胞的影响;
(2)缺点:耗时较长,提取得到的EV为细胞间隙EV和细胞在体外环境培养过程中分泌的EV。